Imager l'œil sans en perturber le fonctionnement natif

Quand je lui demande ce qui l’a amené à travailler à l’Institut de la Vision, Tual Monfort me répond : « l'œil, ce n'était pas forcément ma motivation principale ». Une position inhabituelle pour quelqu’un qui travaille à l’Institut de la Vision, mais qui s’explique par le profil de l’ingénieur de recherche. Ce physicien de formation s’est spécialisé dans l’optique et la photonique, la science qui permet de générer, contrôler et détecter les particules de lumières que sont les photons.

Tual Monfort, ingénieur de recherche dans l'équipe de Kate Grieve, département de photonique, à l’Institut de la Vision.
Un focus : la construction de systèmes optiques innovants
Lors de sa thèse au Royaume-Uni, Tual Monfort doit travailler à la mise au point d’un microscope qui permette d’identifier les gouttelettes lipidiques et le collagène dans les processus liés au cancer. Le jeune chercheur commence alors à explorer l’axe de recherche qui est toujours le sien aujourd’hui, et qui l’a fait intégrer l’équipe de Kate Grieve : la création de toutes pièces de systèmes d’imagerie innovants. « Je construis chacun de ces appareils pour répondre à une problématique biologique bien identifiée. J’agence chaque pièce détachée, chaque miroir, les sources laser… et je crée également les softwares de contrôles de ces appareils. Comme ce sont des machines souvent uniques, ou en très peu d’exemplaires au monde, c’est également moi qui développe les logiciels et les algorithmes de traitement d’images pour en extraire les données pertinentes et les rendre intelligibles par les biologistes avec qui je travaille en étroite collaboration. Pour ça, j’ai recours à l’intelligence artificielle », détaille le physicien.
Après un détour par l’Arabie Saoudite, en tant que consultant technologique sur une version plus sophistiquée du système qu’il a développé durant sa thèse, Tual Monfort rejoint Cardiff pour un post-doctorat. Sa mission sur place : construire une machine qui permettre d’étudier les membranes bilipidiques. L’occasion également de se former aux techniques d’holographie. C’est l’éventail large de ses aptitudes acquises en instrumentation, en IA, et dans les nombreuses techniques d’optique qui permettent d’imager différents types de tissus qui le fait repérer par Kate Grieve lors de son retour en France en mai 2020. Leur collaboration commence alors qu’il est en poste à l’Institut Langevin - où il conçoit, en collaboration avec Olivier Thouvenin, maître de conférences à l'Institut Langevin, son premier prototype.
Puis, à la fin de l’année 2021, il rejoint l’équipe que Kate Grieve dirige à l’Institut de la Vision, en tant qu’ingénieur de recherche, emmenant avec lui le prototype de microscope sur lequel il travaille, et qui est maintenant en utilisation quasi constante dans une des salles de l’Institut de la Vision.

Le dispositif d'imagerie créé par Tual Monfort et installé à l'Institut de la Vision © DR
Se substituer à la fluorescence pour une imagerie plus proche du réel
À l’heure actuelle, la recherche à visée médicale se fait essentiellement sur des modèles cellulaires, et des modèles animaux non humains. Et ce jusqu’au moment du passage en clinique. Or, de par leur nature même, les cultures cellulaires, majoritairement monocellulaires et en deux dimensions, ne donnent qu’une image déformée de ce qui se passe réellement in vivo, dans un corps humain avec un système vasculaire, immunitaire, hormonal, qui fonctionne en 3D. Les résultats qu'on obtient à partir de ce qu'on observe sur les cultures cellulaires 2D ne sont donc qu’une approximation du fonctionnement réel in vivo. Et s’il est éventuellement possible de travailler sur des explants, des fragments de tissu complexe ou d’organismes, ils sont souvent difficiles à obtenir et à maintenir dans le temps.
« A l’Institut de la Vision, Tual Monfort développe des systèmes, uniques au monde, d’imagerie sans marquage. Une alternative à l’imagerie de fluorescence, la technique étalon du domaine. »
De ce point de vue, la mise au point des organoïdes a été une vraie révolution technologique (voir l'article "Phénotypage, génotypage, intelligence artificielle, jumeaux numériques... une nouvelle ère pour la médecine personnalisée"). Ces mini-organes, issus de cellules humaines, répliquent de façon beaucoup plus fidèle les conditions physiologiques et on y retrouve les différents types cellulaires, dans les mêmes proportions qu’in vivo. « Et puis c’est du tissu humain, on est donc plus proche de ce qui se passe dans le corps humain que lorsqu’on travaille sur des modèles animaux. Mais pour pouvoir étudier les mécanismes natifs, il faut pouvoir les imager sans interférer avec leur fonctionnement. Or, quand on fait de l’imagerie par fluorescence, on modifie nécessairement ce qu’on veut observer », déplore Tual Monfort.
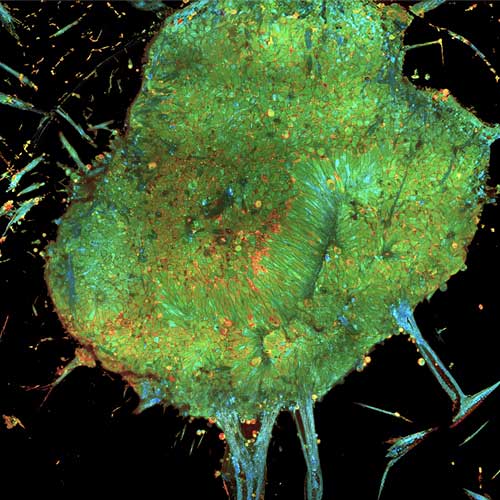
Prise de vue à l'intérieur d'un organoïde de rétine (à 38 jours de développement) imagé avec le système d'OCT plein champ dynamique. © Copyright Institut de la Vision - Tual Monfort
En effet, il existe principalement deux façons de faire de l’imagerie de fluorescence :
- Soit en appliquant un marquage aux échantillons après une étape de fixation. Cet étiquetage se fait le plus souvent grâce à un anticorps fusionné à un fluorochrome, et qui va venir s’accrocher spécifiquement à la protéine ou toute autre molécule qu’on veut marquer spécifiquement.
- Soit par la modification génétique des molécules d’intérêt à l’intérieur des organoïdes humains (ou des modèles animaux ou cellulaires) pour leur faire exprimer une petite étiquette fluorescente. Il devient alors possible de suivre les aspects dynamiques du comportement cellulaire, de la migration des cellules ou de leurs molécules.
« La fluorescence est une technique extrêmement puissante. Elle permet de comprendre plein de choses, mais nécessite de fixer l'échantillon pour pouvoir l'imager, et de savoir ce que l’on cherche à voir à l’avance. Or, le processus de fixation peut induire des changements morphologiques, par exemple en provoquant la précipitation de certaines structures. De plus, toute caractérisation en direct, dynamique, liée à l’état physiologique de l’échantillon, est impossible. Ainsi, on manque la moitié de l’histoire ! Ce qu’on observe en coupe 2D fixée n’est donc pas forcément révélateur de l’état dynamique 3D du vivant, et ne peut pas être directement transposé », développe Tual Monfort. Qui reprend : « Quant à la modification génétique, de nombreux articles pointent que ce fait d’attacher un fluorochrome à une autre molécule protéine ou lipide, va modifier son comportement natif. On ne sait pas si le biais qui en résulte est de l’ordre de 1%, ou de 50%, mais cela apporte un doute sur la transposition de ce qu’on observe vers le fonctionnement naturel dans l’organisme non modifié. D’autant que si on se met à observer non pas une, mais cinq, dix protéines d’intérêt, on démultiplie le biais ».
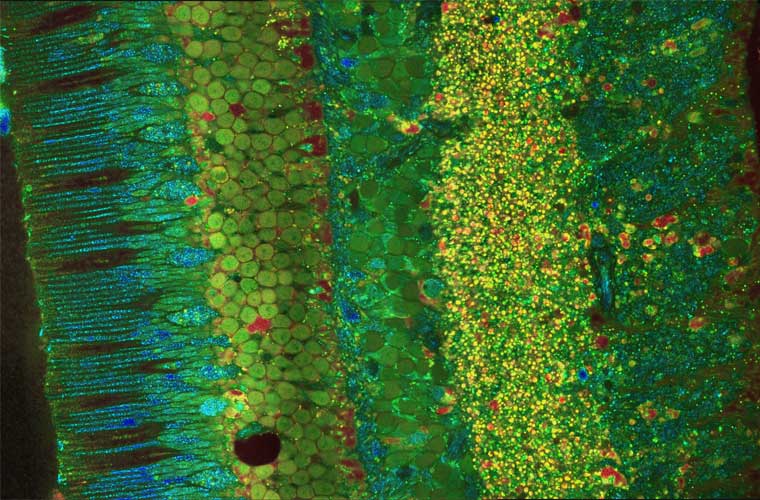
Image prise par OCT sur un explant de rétine de macaque. On peut y voir les différentes couches cellulaire constituant la rétine. On peut voir à gauche les cônes et les bâtonnets de manière individuelle, et chaque cellule de chaque couche. © Copyright Institut de la Vision - Tual Monfort
Un saut technologique pour les techniques sans marquage
Il était donc nécessaire selon le physicien et son équipe de développer des techniques d'imagerie sans marquage, à haute résolution, pour caractériser l’ensemble de ces organoïdes dans leur état natif, non altéré. Or, historiquement, toutes les techniques sans marquage ne sont applicables qu’à la culture cellulaire en deux dimensions, pour une raison simple : la lumière traverse difficilement des tissus épais. « C’est un peu comme essayer de voir au travers d’un brouillard » décrit Tual Monfort. Développer un microscope dédié à l’imagerie sans marquages des organoïdes rétiniens a donc été un défi technologique, qui à l’heure actuelle n’a été relevé par aucune autre équipe de recherche. « Moi, j'étudie comment, en envoyant de la lumière sur des échantillons, on peut récupérer une information très spécifique qui va nous permettre de reconnaître une cellule A, une cellule B, etc. Ce que nous avons mis au point avec Kate Grieve ces 3-4 dernières années, c'est vraiment une percée dans l'imagerie des tissus épais sans marquage. »
La technique qu’ils utilisent est celle de la tomographie par cohérence optique plein champ dynamique, dite OCT plein champ dynamique, ou FFOCT dynamique. Cette technologie a été développée en 2017 par Kate Grieve et Olivier Thouvenin durant la thèse de ce dernier à l’Institut Langevin, sous la supervision de Claude Boccara. Si son processus est fort complexe, « on peut faire une analogie avec la technologie d’échographie, qui utilise les propriétés des ultrasons pour obtenir une image lorsque ceux-ci se réfléchissent sur les organes. Ici, on fait sensiblement la même chose, mais avec des photons. Nous sommes capables de mesurer combien de temps un photon va mettre à revenir d'une couche bien définie, ce qui nous permet de ne sélectionner que ceux qui viennent d’un plan donné, et donc d’obtenir une sorte de coupe 2D, dans une structure en 3D », simplifie Tual Monfort.
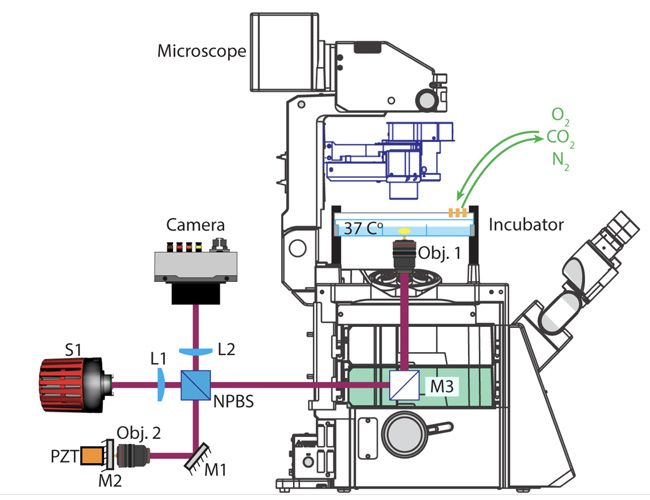
Schéma simplifié du système de tomographie par cohérence optique plein champ dynamique. Celui-ci est ici monté sur un microscope intégrant un incubateur pour le suivi dans le temps des organoïdes. © DR
Détecter des micromouvements spécifiques des différents métabolismes cellulaires
Mais ce qui permet d’identifier les différents types cellulaires est encore plus subtil. La technologie d’OCT plein champ dynamique permet en effet de mesurer des fluctuations de l’ordre du nanomètre. Or, « les nano oscillations qui agitent certains des composants de nos cellules, nos mitochondries par exemple, [les usines énergétiques des cellules], sont révélatrices de l’activité cellulaire. Et cette activité va être assez spécifique pour qu'on puisse distinguer un photorécepteur d'une cellule de Müller par exemple », s’enthousiasme le chercheur. En couplant l’analyse du suivi de ces fluctuations dans le temps avec la morphologie des cellules observées, il est ainsi possible de caractériser finement quel type cellulaire on a effectivement sous le microscope. Un cran plus loin, la technologie permet d’extraire une multitude de métriques à l’échelle tissulaire, que ce soit la position des cellules, la densité de chaque type cellulaire, leur activité métabolique, leur déplacement dans le temps… ce qui permettra, sans repasser à l’échelle moléculaire, de caractériser physiologiquement les réponses des tissus et des organoïdes à d’éventuels candidats médicaments.
Dès 2020, la première preuve de principe de l’efficacité de cette technologie pour imager les organoïdes est faite. C’est ce qui mènera à l’embauche de Tual Monfort, afin de construire une machine incluant cette technologie et pouvant se greffer à un microscope optique commercial pour constituer une plateforme d’imagerie utilisable par les biologistes tout en améliorant le cœur de la technologie. Or, ce type de technologie nécessite classiquement des tables optiques sur vérins hydrauliques, bardées de miroirs, de fibres et de sources laser. « Ce n’était pas vraiment une technologie qu’on peut imaginer être utilisée par quelqu’un qui n’est pas physicien spécialisé en photonique. Mon travail a constitué tout d’abord à adapter cette technologie pour la rendre compatible avec les microscopes commerciaux, puis à la miniaturiser et à la standardiser », explique Tual Monfort. Deux brevets et une start up en cours de création plus tard, le résultat est un module qu’il suffit de brancher sur n’importe quel microscope, « ce qui permet du coup de coupler l’OCT dynamique plein champ à l’imagerie par fluorescence », souligne l’ingénieur de recherche. Pour soutenir ce développement, Kate Grieve a d’ailleurs reçu une bourse « Preuve de concept » du European Council of Research à l’été 2023, qui vient compléter le financement européen obtenu en 2021 pour développer la technologie, ainsi que celui de l’ANR qui, dès 2019, a cru au potentiel de cette technologie.

Le système, sur table optique, qui permet d'obtenir la technique de tomographie par cohérence optique plein champ dynamique. © Tual Monfort
De nombreux développements à venir
Dans un premier temps, l’analyse s’est faite de façon qualitative, ce qui a permis de constater qu’il y avait effectivement des types de cellules présentant des profils d’activité différents. L’objectif est maintenant d’automatiser la reconnaissance grâce à l’intelligence artificielle, ce qui nécessitera une phase d’étiquetage méticuleux des différents types cellulaires identifiés grâce à leur profil métabolique. Pour ce faire, Tual Monfort construit à l’heure actuelle une banque de signaux métaboliques temporels attribués spécifiquement à chacun des types cellulaires. Un travail de fourmi, qui se fait notamment grâce au concours de… la microscopie par fluorescence ! « J’établis des correspondances en utilisant des marquages fluorescents très spécifiques, exprimés dans des cellules que j’observe en même temps en OCT dynamique plein champ. Cela me permet de certifier que tel signal temporel correspond à tel type cellulaire. C’est ce qui est génial dans le fait de pouvoir avoir les deux technologies d’imagerie, et pourquoi pas d’autres également, montées sur le même microscope ! » s’enthousiasme celui qui passe à l’heure actuelle les concours du CNRS et de l’Inserm.
De plus, les chercheurs ont choisi d’y adjoindre un incubateur, pour pourvoir suivre le même organoïde au cours de sa maturation, durant plusieurs semaines. « On peut, un peu comme avec un IRM, voir à l'intérieur de cet organoïde chaque cellule individuelle, identifier son type cellulaire et suivre son évolution au cours du temps, comment elle va se déplacer… J’ai même développé un software qui permet que tout ce suivi soit automatisé », explique Tual Monfort. Un incrément technologique de taille donc, qui pourrait à terme être utilisé pour la sélection de candidats médicaments. Une fois ceux-ci identifiés par criblage sur culture cellulaire, il « suffirait » de les administrer à des organoïdes modèles de pathologies rétiniennes, et d’observer la réaction physiologique de ces derniers.
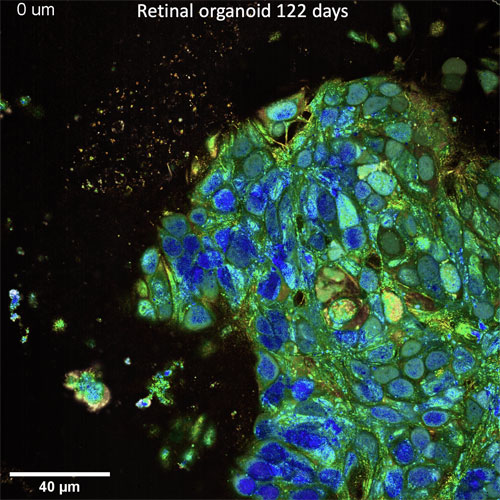
Image d'une partie d'un organoïde rétinien de 122 jours. © Copyright Institut de la Vision - Tual Monfort
Un Everest, l'imagerie In Vivo ?
Pour autant, transposer sur un patient vivant une technologie basée sur l’analyse au nanomètre près des vibrations des composants cellulaires semble un sommet encore lointain. « Pour l’instant, cela ne fonctionne pas. Notre système est tellement sensible que, malgré nos tables optiques extrêmement épaisses, on peut voir le signal d’une personne qui parle dans la pièce d’à côté. Alors imaginez observer un patient qui respire. Cela implique des solutions de tracking incroyablement efficaces. Il faut également supprimer les mouvements oculaires. Donc vous ne pouvez pas avoir un patient réveillé, mais pas non plus l’endormir…» commente Tual Monfort.
Dans l’équipe de Kate Grieve, l’avenir est plutôt à la détection des processus neuronaux, en utilisant comme modèle le Zebrafish. « Même si le microscope a été conçu pour l’observation des organoïdes, on s’est aperçus qu’il fonctionne très bien pour le poisson zèbre, qu’on peut maintenir en vie dans notre incubateur. Et, avec un autre type de technologie OCT, on est capables d’observer une élongation des photorécepteurs quand ils s’activent en présence de lumière. C’est un projet vraiment en cours, mais on pourrait imaginer, vue la sensibilité qui est celle de notre technologie, pouvoir suivre la déformation des axones sous l’influx nerveux qui les traverse ». Le but ici, au-delà du poisson modèle, est de pouvoir à termes cartographier le réseau neuronal de la rétine.
Soutenez la recherche , soutenez l'Institut de la Vision >

Propos recueillis par Aline Aurias
À lire aussi

Dr Kate Grieve, Optoretina et l'imagerie rétinienne haute résolution
Notre série 100% féminine se poursuit !

La dégénérescence maculaire liée à l'âge : DMLA

L'anatomie de l'œil
La vue est le plus sollicité de nos 5 sens. Elle nous permet de percevoir les couleurs, les formes, les positions. Elle est essentielle pour intégrer et apprécier le monde qui nous entoure, pour communiquer avec les autres. Admirer ses proches, contempler la nature, observer un tableau, lire un livre, se déplacer, travailler, créer...









